Mitä oksideja ovat?
Jos et ole kiinnostunut kemiasta koulussa, olet epätodennäköistätarkkaile, mitä oksidit ovat ja mikä niiden rooli ympäristössä on. Itse asiassa tämä on varsin yleinen yhdiste, joka esiintyy useimmiten ympäristössä veden, ruosteen, hiilidioksidin ja hiekan muodossa. Myös oksidit ovat mineraaleja - eräänlainen kivi, jolla on kiteinen rakenne.
määritelmä
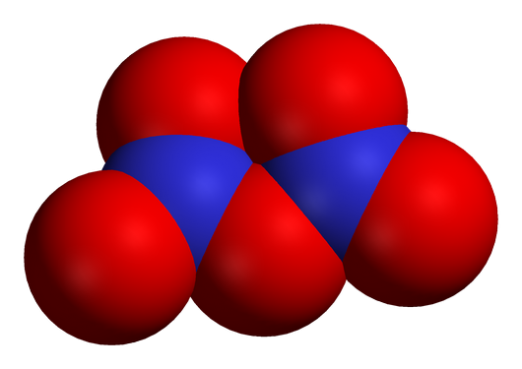
Oksidit ovat kemiallisia yhdisteitä kaavassajotka sisältävät vähintään yhtä happiatomia ja muita kemiallisia elementtejä. Metallioksidit sisältävät pääsääntöisesti hapen anion hapettumistilassa -2. Merkittävä osa maapallon kuoresta koostuu kiinteistä oksideista, jotka ovat peräisin alkioiden hapettamisesta hapella ilmasta tai vedestä. Hiilivedyn polttamisen aikana muodostuu kahta päähiilidioksidia: hiilimonoksidi (hiilimonoksidi, CO) ja hiilidioksidi (hiilidioksidi, CO2).
Oksidien luokitus
Kaikki oksidit on jaettu kahteen suureen ryhmään:
- suolaa muodostavat oksidit;
- ei-suolaa muodostavat oksidit.
Suolaa muodostavat oksidit ovat kemikaaleja, joissa hapen lisäksi on elementtejä metalleista ja ei-metalleista, jotka muodostavat happoja kosketettaessa vettä ja yhdistettyinä emäksiin, suoloihin.
Suolaa muodostavat oksidit jaetaan edelleen edelleen:
- perusoksidit, joissa hapetuksen aikana toinen elementti (1, 2 ja joskus 3 valenssimetalli) tulee kationiksi (Li2O, Na2O, K2O, CuO, Ag2O, MgO, CaO, SrO, BaO, HgO, MnO, CrO, NiO, Fr2O, Cs2O, Rb2O, FeO);
- hapon oksideja, joissa suolan muodostuksen aikana toinen osa kiinnitetään negatiivisesti varautuneeseen happiatomiin (CO2, SO2, SO3, SiO2, P2O5, CrO3, Mn2O7, NO2, Cl2O5, Cl2O3);
- amfoteeriset oksidit, joissa toinen elementti (3 ja4-valenssimetallit tai poikkeukset, kuten sinkkioksidi, berylliumoksidi, tinaoksidi ja lyijyoksidi) voivat tulla sekä kationiksi että anioniksi (ZnO, Cr2O3, Al2O3, SnO, SnO2, PbO, PbO2, TiO2, MnO2, Fe2O3BeO).
Ei-muodostuvilla oksideilla ei ole happamia, emäksisiä tai amfoteerisiä ominaisuuksia, ja kuten nimestä käy ilmi, ne eivät muodosta suoloja (CO, NO, NO2, (FeFe2) O4).
Oksidien ominaisuudet
- Oksidien happiatomit ovat korkeatkemiallinen aktiivisuus. Koska happiatomi on aina negatiivisesti ladattu, se muodostaa stabiileja kemiallisia sidoksia lähes kaikkien elementtien kanssa, mikä aiheuttaa monenlaisia oksideja.
- Noblemetallit, kuten kulta ja platina,on arvostettu, koska niitä ei luonnollisesti hapeteta. Metallien korroosio muodostuu hydrolyysin tai hapetuksen seurauksena. Veden ja hapen yhdistelmä nopeuttaa vain nopeutta.
- Veden ja hapen (tai yksinkertaisesti ilman) läsnäollessa tiettyjen aineosien, esimerkiksi natriumin, hapetusreaktio tapahtuu nopeasti ja voi olla vaarallista ihmisille.
- Oksidit luovat suojaavan oksidikalvonpintaa. Esimerkkinä mainittakoon alumiinifolio, joka alumiinioksidin ohuen kalvon pinnoituksen johdosta joutuu korroosiota paljon hitaammin.
- Useimpien metallien oksideilla on polymeerinen rakenne, joten ne eivät hajoa liuottimien vaikutuksesta.
- Oksidit liukenevat hapon ja hapon vaikutuksen alaisenaperustein. Oksidit, jotka voivat reagoida sekä happojen että emästen kanssa, kutsutaan amfoteeriksi. Metallit muodostavat pääsääntöisesti emäksiset oksidit, eivät metallit happooksidit ja amfoteeriset oksidit saadaan alkalimetallit (metalloidit).
- Metallioksidin määrää voidaan vähentääjoitain orgaanisia yhdisteitä. Nämä redox-reaktiot ovat perusteella monia tärkeitä kemiallisia muutoksia, kuten vieroitus lääkkeiden vaikutuksen alaisena P450-entsyymien ja etyleenioksidin, josta sitten tuottaa pakkasnestettä.
Ne, jotka ovat kiinnostuneita kemia, ovat myös kiinnostuneita seuraavista artikkeleista:
- Mikä on hapen sisältö?
- Miten saada rikki
- Miten saada rikkihappoa